出口美国Export to the US
如果您是生产医疗器械的企业,希望进军美国市场。我们能为您提供如下的服务方案:
1. 判定该医疗器械在美国食品药品监督管理局(FDA)的具体分类
2. 作为您的美国代理人U.S. Agent
3. FDA医疗器械企业登记与产品列名(含FDA美金年费支付指导)
4. 医疗器械FDA 510(k)注册辅导
5. QSR 820质量体系建立辅导
6. FDA官方审核辅导陪审
1、判定该医疗器械在美国食品药品监督管理局(FDA)的具体分类
在美国谁监管医疗器械?
想要在美国上市销售医疗器械,会受到来自FDA即美国食品和药品管理局(Food and Drug Administration)的监管。并应遵守相关法规控制,基于不同的器械风险去满足相应的市场监管途径。
FDA是什么?
FDA是美国食品药品监督管理局(Food and Drug Administration)的简称,隶属于美国国务院保健与服务部 (U.S. Department Of Health and Human Services)的公共健康服务署(Public Health Service)。
FDA是国际医疗审核权威机构,由美国国会即联邦政府授权,是从事食品,药品,医疗器械,辐射发射类产品,疫苗,血液和生物制品,动物和兽医用产品,化妆品和烟草产品管理的 高执法机关。
FDA对医疗器械是如何分类的?
FDA通过其器械与放射健康中心(CDRH)进行医疗器械的监管。
1)根据器械风险高低
FDA实行一种三层监管体系,将医疗器械按照其给患者或使用者带来的风险性由低到高依次分为Class I, II, III三个大类,越高监管越严格。如下表所示:
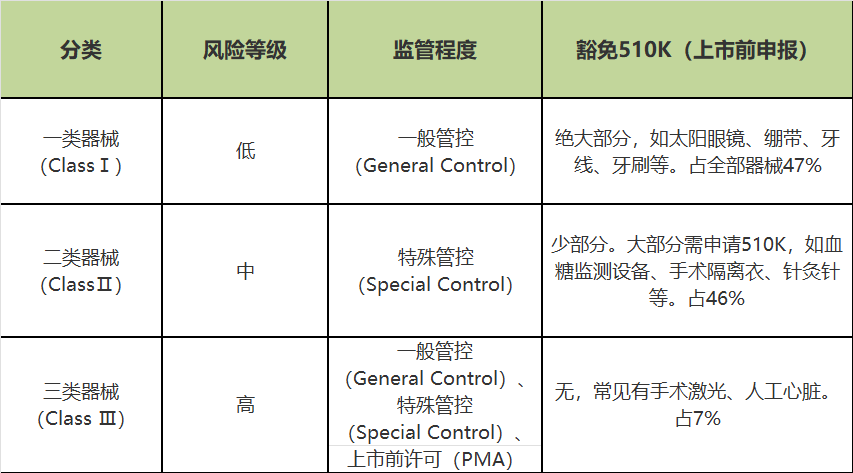
2)根据器械用途
FDA把现有医疗器械分成16类、1700种,包含近6000个产品代码。
每个产品代码都需要对应一个产品注册号码Medical Device Listing Number (MDL)后,该医疗器械才可以合法在美国海关通关和上市销售。
3)在判定您医疗器械分类时,沙格可以做什么?
美国FDA对医疗器械的分类采一种基于原型的分类系统。
尽管在大多数情况下,您可以通过FDA官网相关资源判定出您医疗器械的正确分类以及对应product code。 然而,这看起来容易,但要为您的医疗器械从FDA数据库中上千种不同代码里找到 接近的原型,往往有一定难度。
沙格拥有多年的丰富经验,对FDA分类数据库有较为深入的了解,可帮助您来正确对医疗器械进行分类。
4)其他资源
有关可能适用于您的器械的监管控制(一般和特殊控制)的更多信息,请查看法规控制网页。https://www.fda.gov/medical-devices/overview-device-regulation/regulatory-controls
以下资源可以帮助您确定您的器械的分类:
· FDA Product Classification Database
· Device Classification Panels
· Classify Your Medical Device
2、作为您的美国代理人U.S. Agent
21CFR part 807.40(a) 规定任何从事生产、准备、组合或加工成品医疗器械并将产品进口到美国的美国海外厂商都需要进行工厂注册(Establishment Registration)和医疗器械列示(Medical Device Listing)。
美国境外企业的美国代理人的信息使用FDA Unified Registration and Listing System (FURLS 系统) 以电子方式提交,并且是企业注册流程的一部分。每个外国企业只能指定一名美国代理人。外国企业应提供美国代理人的名称,地址,电话和传真号码以及电子邮件地址。
确定的美国代理人将被要求完成自动程序以确认他们已同意担任美国代理人。自动程序会将电子邮件验证请求转发给美国代理人。他们将被要求确认她/他同意代表外国企业担任代表/联络人。如果美国代理人拒绝同意(或在10个工作日内没有回复),外国企业的官方通讯员/所有者运营商将收到通知,并且必须指定一名新的美国代理人以履行监管义务。
根据联邦法规807.40(b)的要求,美国代理人的职责包括以下:
1)根据FDA的要求,协助FDA与国外厂商沟通;
2)对国外厂商进口到美国的产品出现的问题进行回复;
3)帮助FDA安排国外厂商的厂商检查活动;
4)如果FDA无法直接或迅速联系外国企业,FDA可能会向美国代理人提供信息或文件,此类行为应被视为等同于向外国企业提供相同的信息或文件。
3、FDA医疗器械企业登记与产品列名
FDA医疗器械企业注册、产品列名的流程
1) 填写FDA医疗器械企业申请表
2) 查询医疗器械产品分类代码
3) 申请付款码,指导付款,获得收款码
4) 为企业申请FDA医疗器械企业注册
5) 提交注册,获得企业操作号、产品列名号
FDA注册周期
通常总的注册周期为1-2周(前提是企业给美国FDA付年费不耽误时间)。
时间具体情况如下:
Day1 确认收到您支付给sungo的服务费后,立项;
Day2-4 我们为您申请PIN(Payment Identification Number),提供付款指南并详细指导您向FDA支付年金;
Day5-9 FDA确认收到美金年费,发放PCN(Payment Confirmation Number );
Day10-13 我们依据您填写的申请表完成企业注册、产品列名。
届时您将获得:即时生成的owner number 与 listing number.
但是registration number,这个号码是由FDA后台系统分配,一般是在注册动作完成后90天左右才会分配下来。
FDA注册有效期
本年度10月1日-次年9月30日,为FDA注册的一个有效周期。
如2020年10月10日完成注册,有效期是到2021年9月30日。
美国FDA要求,注册信息必须在每年10月1日至12月31日期间,进行年度更新。
4、医疗器械FDA 510(k)注册辅导
什么时候需要进行510(k)上市前通告申请?
通常来说,想要把II类医疗器械(以及少量的I类和III类器械)或体外诊断器械(IVD)推向美国市场进行销售时,制造商必须向FDA提交510(k)上市前通告申请。
对其医疗器械的预定用途进行更改,或者对一项已经获得批准的医疗器械的技术进行更改并可能明显对该器械的安全性或有效性造成影响的情况下,制造商也必须提交一份510(k)上市前通告。
FDA 510(k)的基本原理是证明新的或经改动的器械与已经在美国合法上市的器械(比对器械)实质性等同。
FDA510K申报辅导服务内容
1)根据您的产品信息确定该产品的分类与代码
2)根据确定的产品代码寻找对应的注册指南或相关文件,协助您寻找合适的比对器械,确定需要您准备的资料和检测项目
3)在您准备资料和检测的过程中提供法规技术支持
4)根据您提供的相关资料编制510K报告
5)指导您向FDA递交小企业资质申请( 终审批由FDA决定)
6)向FDA申请付款号码,指导您向FDA支付报告评审费
7)递交510K报告至FDA进行评审,负责与FDA联络沟通,并指导协助企业进行整改,直至项目评审结束
FDA 510K申报的基本流程与周期
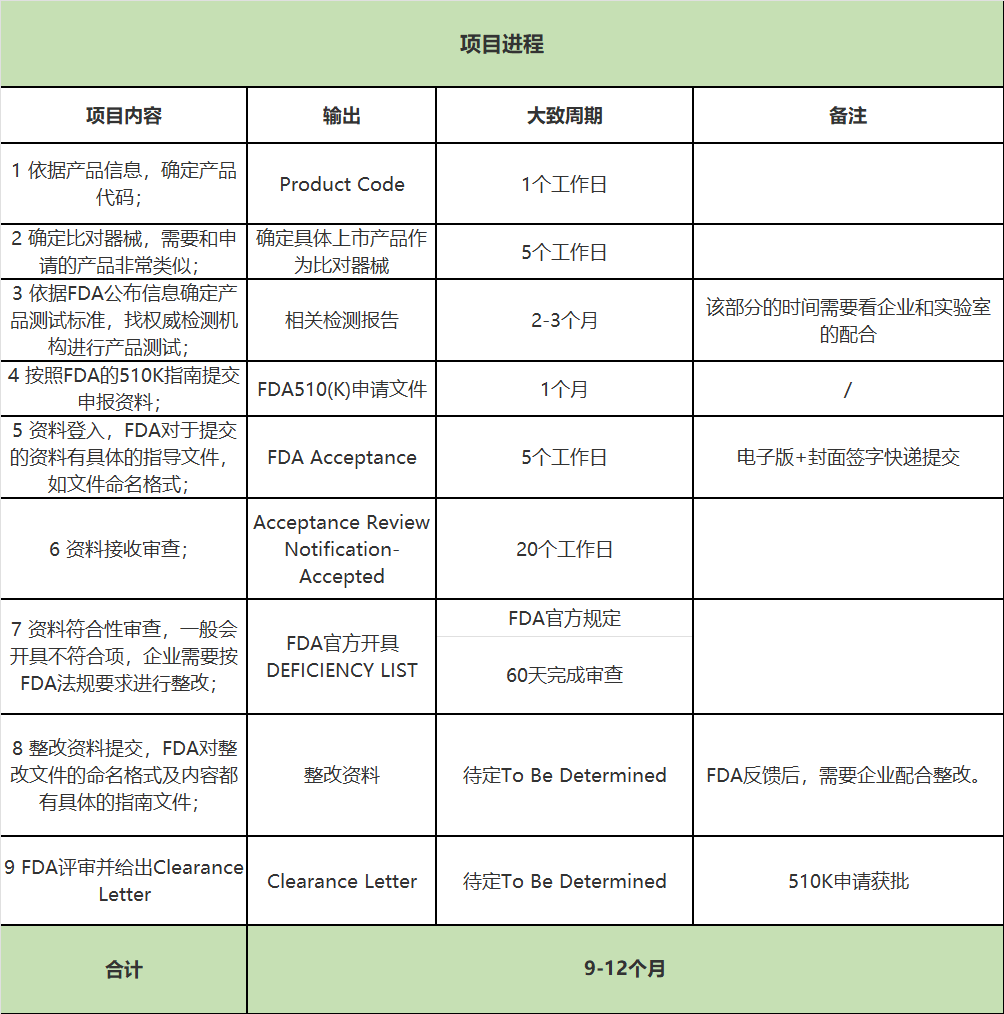
5、QSR 820质量体系建立辅导
QSR 820 医疗器械良好操作规范
美国FDA要求医疗器械制造商必须实行符合21 CFR第820部分中-医疗器械质量体系规定(QSR)的质量体系。这个质量体系规定(QSR820)与ISO 13485关于质量管理体系的标准是相似的,但不是完全相同。
谁必须依据美国FDA QSR820建立质量体系?
1)生产制造一种医疗器械或体外诊断器械(IVD)的企业;
2)负责医疗器械设计开发和上市销售后的相关活动的企业,因此,大多数销售医疗器械或体外诊断器械(IVD)的公司都必须建立QSR820质量管理体系。
QSR 820导入的时机
对于生产医疗器械的企业,我们建议一旦有医疗器械出口就可以考虑导入QSR 820标准。因为美国FDA每个财年都会随机抽查进行海外官方审厂,为避免今后FDA对您进行随机验厂时接到警告信(Warning Letter),影响出货,建议您尽早导入QSR820标准。我们也可为您提供QSR820体系相关法规培训。
QSR 820服务的流程和周期
1) 当前管理体系的诊断并出具差距报告
2) 策划QSR 820的导入计划
3) 硬件改造
4) 体系建立和人员培训
5) 试运行以及模拟审核
通常体系文件发布后,体系要试运行三个月,因此整个辅导周期为4-6个月。
6、FDA医疗器械验厂辅导
指的是当医疗器械的生产企业,被美国FDA抽查到验厂时,需要聘请第三方专业机构提供咨询辅导。
FDA验厂的依据是如下:
1)法律依据——FD&C ACT 食品药品及化妆品法案
2)法规——21 CFR PART 820 , 即QSR (以前叫做cGMP)
21 CFR PART 803, 即MDR (医疗器械不良反应报告)
21 CFR PART 801, 有关标签的规定
21 CFR PART 807, 厂商注册,510(K)等方面的相关规定
3)审核指南——QSIT Quality System Inspection Technique (质量体系检查技术)
QSIT 的四个部分: 管理职责(management control), 设计控制(design control), 生产和过程控制(p&pc), 纠正预防措施(CAPA)
FDA 验厂辅导的时机
通常美国FDA会在确定评审日期约2个月之前通知被评审的企业。
我们建议被评审的企业接到通知的第一时间和我们取得联系,因为整体的准备时间非常短。
当然我们更加鼓励那些已经有医疗器械出口美国,但是尚未收到美国评审通知的企业寻求我们的辅导以做准备。
服务的流程和周期
1.现已有质量管理体系与法规要求的差距
2.咨询过程的整体设计,包括现场的整改以及文件化体系以及应用的整改;
3.收集现有的文件资料:质量手册,程序文件,作业指导书,工艺文件,检验规程,记录等
4.基于FDA审核要求文件记录审阅、检查生产全过程GMP、设备设施维持GMP内容,咨询师与企业相关人员一起进行文件系统修整;
5.帮助企业发现车间和仓库的不足与整改;
6.对企业人员进行迎接审核技巧的培训;
7.体系有效性的检查,在FDA来审核之前,安排本公司评审员进行模拟审核;
8.陪同FDA验厂,陪同FDA检查官进行验厂并负责翻译沟通。
周期:通常在接到通知到FDA评审完毕,历时2个月。



